"2º ANO" 3º BIMESTRE-2024: Termoquímica e Cinética Química
Termoquímica
Habilidades Cognitivas
8.1.2. Identificar as variações de energia nas representações de processos de dissolução e nas mudanças de fase.
8.2.1. Saber que nas TQ a energia térmica do sistema inicial pode ser diferente da energia do sistema do final.
8.3.2. Saber diferenciar processo endotérmico de exotérmico.
31.1.3. Compreender a representação da variação de energia de uma TQ por meio de gráficos.
31.2.2. Compreender os procedimentos utilizados para efetuar cálculos, utilizando a Lei de Hess
31.2.3. Compreender os procedimentos utilizados para efetuar cálculos utilizando as energias de ligação.
31.2.4. Utilizar dados tabelados para os procedimentos de cálculos de variação de energia.
É o estudo das energias aplicadas às tranformações: física e/ou química.
T. Física
Sistema endotérmico

Sistema exotérmico
T. Química

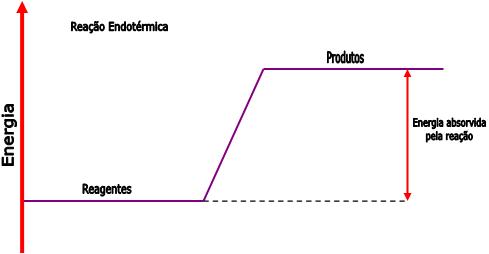
T.Q. Endotérmica: É aquela na qual a quantidade de energia absorvida para romper as ligações, entre os átomos, que constituem os reagentes é maior que a energia liberada na união entre os átomos na formação dos produtos.
A transformação química endotérmica pode ser identificada através das três maneiras abaixo:
Reagentes --> Produtos ∆H positivo;
Reagentes + energia --> Produtos;
Reagentes (estado inicial) ter menos energia do que os produtos (estado final):
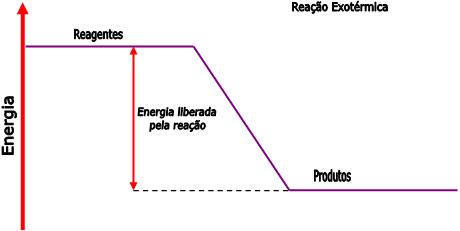
T.Q. Exotérmica: É aquela na qual a quantidade de energia absorvida para romper as ligações, entre os átomos, que constituem os reagentes é menor que a energia liberada na união entre os átomos na formação dos produtos.
A transformação química endotérmica pode ser identificada através das três maneiras abaixo:
Reagentes --> Produtos ∆H negativo;
Reagentes --> Produtos + energia;
Reagentes (estado inicial) ter mais energia do que os produtos (estado final):
Entalpia (H)
É a energia interna ou potencial que cada substância tem armazenada em si. Uma parte desta energia química esta nas ligações entre os átomos e na união entre as moléculas, a outra parte na forma de energia térmica referente aos movimentos de translação, rotação e vibração de átomos e moléculas.

Variação de entalpia (∆H) é a diferença entre a entalpia dos produtos (HP) pela entalpia dos reagentes (HR), numa reação à pressão constante.
Fatores que influenciam nas entalpias (ou calores) das reações:
_Quantidades de reagentes e de produtos: quanto mais reagentes ou produtos maior será a quantidade de calor envolvido na reação. Por exemplo, quanto mais gasolina cair, maior a quantidade de calor liberada pela queima:

_O estado físico dos reagentes e dos produtos da reação: a substância quando produzida no estado físico sólido apresenta menos energia interna, assim acaba liberando mais calor para o ambiente (vizinhaça), já a substância quando produzida no estado físico gasoso apresenta mais energia interna, assim acaba liberando menos calor para o ambiente:
Tipos de entalpia
_Entalpia de formação (∆Hf): corresponde à variação da entalpia no processo de formação de uma substância composta a partir de seus elementos constituintes (substâncias simples).
H2(g) + 1/2O2(g) --> H2O(g); ∆Hf < 0
_Entalpia de combustão (∆Hcomb): corresponde à variação da entalpia no processo de combustão de um mol de combustível.
Metano ∆Hcomb: - 889,5 kJ/mol
Glicose ∆Hcomb: - 2813,0 kJ/mol
_Entalpia (Energia) de ligação (∆H): é a quantidade de energia necessária para romper 1 mol de ligações. Essa mesma energia é liberada na formação de 1 mol de ligações.
| Ligações rompidas | Ligações formadas |
| 1 mol de H - H: 435,6 kJ | 2 mols de H - O: 942,6 kJ |
| 1/2 mol de O=O: 246,6 kJ | |
| Total absorvido: 682,2 kJ | Total liberado: 924,6 kJ |
| Saldo: | 242,4 kJ de energia liberada |
Cálculo de energia
A quantidade de calor absorvida ou liberada por um corpo pode ser medida por: q = m . c . ∆t, onde:
q é a quantidade de calor;
m é a massa da substância;
c é o calor específico da substância;
∆t é a variação de temperatura da substância.
Observação: 1 cal corresponde a 4,18 joule.
Lei de Hess
A Lei de Hess é uma lei experimental e estabelece que a variação de entalpia de uma reação química depende apenas dos estados inicial e final da reação.
H2O(l) → H2O(v) ΔH= +44 kJ
A Lei de Hess também pode ser chamada de Lei da Soma dos Calores de Reação. É uma forma de calcular a variação de entalpia através dos calores das reações intermediárias.
Para montar as equações e aplicar a Lei de Hess, podemos fazer algumas alterações matemáticas, seguindo as seguintes regras:
- as equações intermediárias devem estar de acordo com a reação global. Coloca-se as equações (dados) na ordem que reagem ou são produzidas. Se não estiverem de acordo, troca-se reagentes com produtos e o sinal da ΔH;
- acertar os coeficientes também de acordo com a reação global. Se a equação for multiplicada, a ΔH também deve ser multiplicada pelo mesmo número.
- realizar o somatório matemático para montar a reação global;
- somar os valores das ΔH das equações intermediárias para achar a ΔH da reação global.
Exemplo:
Qual o valor da variação de entalpia da reação a seguir?
Equação global: C6H14(l) -> C6H6(l) + 4H2(g) ΔH = ? KJ/mol
1ª etapa: H2(g) + ½ O2(g) -> H2O(l) ΔH = -286 KJ/mol
2ª etapa: C6H6(l) + 15/2 O2(g) -> 6CO2(g) + 3H2O(l) ΔH = -3268 KJ/mol
3ª etapa: C6H14(l) + 19/2 O2(g) -> 6CO2(g) + 7H2O(l) ΔH = -4163 KJ/mol
Solução:
_Inverta a primeira equação, com isso inverta o sinal de ΔH e multiplique por 4 o seu valor;
_Inverta a segunda equação, com isso inverta o sinal de ΔH;
_A terceira equação permanece a mesma.
H2O(l) -> H2(g) + ½ O2(g) 4 . (ΔH = +286 KJ/mol)
6CO2(g) + 3H2O(l) -> C6H6(l) + 15/2 O2(g) ΔH = +3268 KJ/mol +
C6H14(l) + 19/2 O2(g) -> 6CO2(g) + 7H2O(l) ΔH = -4163 KJ/mol
______________________________________________________________
C6H14(l) -> C6H6(l) + 4H2(g) ΔH = +249 KJ/mol
Observe que as equações químicas das etapas são somadas, obtendo-se a reação global; e que as ΔH depois das devidas mudanças são somadas, obtendo-se o valor da variação de entalpia da reação global.
Cinética Química
É o estudo das velocidades das reações químicas e dos fatores que influênciam nessas velocidades.
Como as reações ocorrem:
Condições fundamentais:
_afinidade química (um reagente tem que ser afim do outro);
_contato (um reagente tem que colidir com o outro de forma orientada, ou seja maior superfície de contato);
_energia eficaz (energia necessária para quebrar o que existe "os reagentes" e ligar os átomos novamente formando "os produtos")
Teoria das colisões:

Energia de ativação (Eat.): é a energia mínima que as moléculas devem possuir para reagir, ao se chocarem (isto é, para termos uma colisão efetiva).

Atividade:
1) (UFRGS) As figuras a seguir representam as colisões entre as moléculas reagentes de uma mesma reação em três situações:
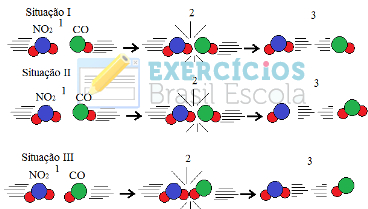
Pode-se afirmar que:
a) na situação I, as moléculas reagentes apresentam energia maior que a energia de ativação, mas a geometria da colisão não favorece a formação dos produtos.
b) na situação II, ocorreu uma colisão com geometria favorável e energia suficiente para formar os produtos.
c) na situação III, as moléculas reagentes foram completamente transformadas em produtos.
d) nas situações I e III, ocorreram reações químicas, pois as colisões foram eficazes.
e) nas situações I, II e III, ocorreu a formação do complexo ativado, produzindo novas substâncias.
2) A figura seguinte mostra o diagrama de energia potencial de uma reação:
A + B → C + D
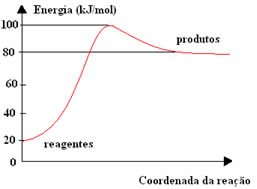
Qual é a energia de ativação para essa reação e qual deve ser a energia do complexo ativado em kJ/mol?
a) 80 e 100.
b) 20 e 100.
c) 60 e 100.
d) 80 e 20.
e) 80 e 60.
Cálculo da velocidade de consumo ou formação:
A velocidade de consumo é aplicada quando se trata de um reagente e a velocidade de formação é quando se trata de um produto, para o cálculo basta dividir a variação da concentração da substância pelo intervalo de tempo correspondente.
Atividades:
3) Observe a tabela abaixo e responda:
a) Qual a velocidade de consumo de A no tempo de 0 a 20 segundos?
b) Qual a velocidade de formação de B no tempo de 20 a 40 segundos?
Cálculo da velocidade média da reação:
A velocidade média de uma reação que apresenta coeficientes estequiométricos iguais pode ser calculada através da velocidade média de consumo de um reagente ou da velocidade de formação de um produto, usando as fórmulas abaixo:

A velocidade média de uma reação que apresenta coeficientes estequiométricos diferentes entre si pode ser calculada através da velocidade média de consumo de um reagente ou da velocidade de formação de um produto dividida por seu respectivo coeficiente:
Vm = Vc/coeficiente do reagente
ou
Vm = Vf/coeficiente do produto
Atividade:
4) (UECE) Seja a reação: X → Y + Z. A variação na concentração de X em função do tempo é:
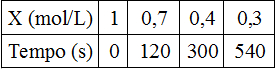
A velocidade média da reação no intervalo de 2 a 5 minutos é:
a) 0,3 mol/L.min.
b) 0,1 mol/L.min.
c) 0,5 mol/L.min.
d) 1,0 mol/L.min.
e) 1,5 mol/L.min.
Fatores que influenciam a velocidade da reação:
Concentração dos reagentes: quanto maior o número de reagentes mais fácil será o contato entre esses, consequentemente mais rápida será a reação.

_Temperatura: quanto maior for a temperatura do sistema, maior será a agitação das partículas, consequentemente mais rápido se encontrarão e mais rápida será a reação.
_Eletricidade: a energia elétrica pode ser usada para aumentar a energia cinética das moléculas e, em função disto aumentar a velocidade dareação. É o que ocorre nos motores dos automóveis onde a faísca elétrica provoca a combustão da gasolina.
_Luz: a luz provoca algumas reações denominadas de REAÇÕES FOTOQUÍMICAS. As principais são: Fotossíntese, decomposição da água oxigenada em água e oxigênio.
_Pressão: nas reações com gases a pressão altera o número de colisões.

Superfície de contato: quando a matéria se encontra o máximo fragmentada, mais fácil a interação dos reagentes e consequentemente mais rápida será a reação.

Catalisador: é a substância que participa da reação apenas facilitando a reação dos reagentes, diminuindo a energia de ativação, o que torna a reação mais rápida, sendo importante salientar que não fará parte do produto formado.

Atividade:
5) (UDESC SC-adaptada) Se um comprimido efervescente, ao nivel do mar (pressão atmosférica=1atm) que contém ácido cítrico e carbonato de sódio for colocado em um copo com água e mantiver-se o copo aberto, observa-se a dissolução do comprimido acompanhada pela liberação de um gás. Assinale a alternativa correta sobre esse fenômeno.
a) Ao ocorrer num local mais elevado, em relação ao nível do mar, a liberação das bolhas será mais rápida.
b) A velocidade de liberação das bolhas aumenta com a elevação da temperatura da água.
c) Se o comprimido for pulverizado, a velocidade de dissolução será mais lenta.
d) A presença de um catalizador vai retardar a transformação.
e) O fenômeno corresponde a um processo físico.
Tópico: "2º ANO" 3º BIMESTRE-2024: Termoquímica e Cinética Química
Nenhum comentário encontrado.
