"2º ANO" 1º BIMESTRE-2024: Estudo dos Gases, Teoria Cinética Molecular e Radioatividade.
Teoria Cinética Molecular
A teoria Cinética dos gases foi sintetizada com o intuito de explicar as propriedades e o comportamento interno dos gases. Compreender essa teoria é algo fundamental para o entendimento da pressão que os gases exercem em outros corpos e em várias outras aplicações. Os principais postulados dessa teoria Cinética dos gases, nos dizem que:
• Os gases são constituídos por um grande número de partículas que estão em movimento contínuo e aleatório, o que justifica a facilidade com que os gases escapam de recipientes.
• O volume das partículas do gás é sempre desprezível.
• A pressão que um gás exerce é o resultado das colisões das partículas do gás com as paredes do recipiente que o contém. As partículas não perdem energia nas colisões (choques elásticos).
• A temperatura absoluta do gás é diretamente proporcional à energia cinética média de suas moléculas. Ecinética média = K . T
• Não existem forças de atração ou repulsão entre as partículas de um gás ideal. As forças intermoleculares são desprezíveis. O comportamento de um gás real se aproxima ao de um gás ideal quando a pressão diminui e a temperatura aumenta. Quanto mais fracas são as forças intermoleculares do gás real , mais o gás se aproxima do comportamento de um gás ideal.
ATIVIDADES
1) Qual das figuras a seguir não apresenta uma característica dos gases em consonância com a teoria cinética molecular dos gases?

2) (UFPE) - Uma lata de “spray“ qualquer foi utilizada até não mais liberar seu conteúdo. Neste momento, podemos dizer que são corretas as alternativas de acordo com a teoria cinética dos gases:
a) A pressão de gases no interior da lata é zero.
b) A pressão de gases no interior da é igual à pressão atmosférica.
c) Existe vácuo no interior da lata.
d) Ao aquecermos a lata, a pressão em seu interior não varia.
e) Ao aquecermos a lata e pressionarmos sua válvula, gases sairão novamente da mesma.
3) Um fato comum em nosso dia a dia é sentir uma certa coceira no nariz quando tomamos de um copo um refrigerante, principalmente quando aberto pela primeira vez, isso ocorre devido a vazão do gás (CO2) que arrasta uma certa quantidade do xarope do mesmo.
Qual das citações da teoria cinética molecular dos gases que mais se adapta a este fato?
Estudo dos Gases
Características dos gases
O gás ideal ou perfeito é um modelo teórico utilizado para prever o compartamento dos gases. Segundo esse modelo, as partículas se movem de forma constante e desordenada e não interagem umas com as outras, ou seja, não há repulsão ou atração entre elas. Nas colisões partícula-partícula e partícula-parede não ocorrem perdas de energia.
Quando os gases estão a baixas temperaturas ou a altas pressões, no entanto, as forças de atração e repulsão não podem mais ser desprezadas. Nessa situação, os gases apresentam comportamento real.
Variáveis de estado de um gás:
Pressão
É a gradeza relacionada à força que um corpo exerce sobre determinada área. Quanto maior a quantidade de partículas, maior será a pressão exercida pelo gás. As unidades de medida mais comuns são: ( atm, mmHg, Pa e (N/m2). A expressão a seguir relaciona essas unidades de medida:
1 atm = 760 mmHg = 1,013x105 Pa (N/m2)
Volume
É a grandeza relacionada ao espaço ocupado pelo gás em determinadas condições de temperatura e pressão. As unidades mais comuns são o litro (L) e o metro cúbico (m3).
Temperatura
É a grandeza relacionada à agitação das partículas em um sistema.

As unidades mais utilizadas são o grau Celsius (ºC) e o Kelvin (K). Para converter uma unidade em outra, utiliza-se a seguinte expressão:
T (K, Kelvin) = t (ºC, graus Celsius) + 273
Volume molar e hipótese de Avogadro
Avogadro constatou que, sob as mesmas condições de temperatura e pressão, volumes iguais de gases diferentes contêm o mesmo número de moléculas. Essa constatação ficou conhecida por hipótese de Avogadro. A 0 ºC e 1 atm (condições normais de temperatura e pressão - CNPT), o volume molar corresponde a 22,4 L.
Transformações gasosas
São transformações provocadas pela alteração das variáveis de estado (temperatura, pressão e volume) de uma quantidade fixa de gás.
Transformação isotérmica (Lei de Boyle)
É o tipo de transformação gasosa que ocorre quando um gás é comprimido ou dilatado, sob temperatura constante.
p1V1 = p2V2 ou p . V = constante

A representação gráfica de uma transformação isotérmica pode ser observada a seguir:

Transformação isobárica
É o tipo de transformação gasosa que ocorre quando um gás é aquecido ou resfriado sob pressão constante. Nessa transformação, o volume do gás varia proporcionalmente com a temperatura absoluta do gás.
V1/T1 = V2/T2 ou V/T = constante

A representação gráfica de uma transformação isobárica pode ser observada a seguir:

Transformação isocórica ou isovolumétrica
É o tipo de transformação gasosa que ocorre em um sistema, sob volume constante.
p1/T1 = p2/T2 ou p/T = constante

A representação gráfica de uma transformação isovolumétrica pode ser observada a seguir:

Equação de estado dos gases
Quando, em uma transformação gasosa, pressão, temperatura e volume se alteram, é possível descobrir o valor das variáveis no sistema final por meio da equação da transformação geral dos gases.
pV = nRT
Em que: R = 0,082 L . atm . K-1 . mol-1 = 62,3 L . mmHg . K-1 . mol-1 = 8,314 L . KPa . K-1 . mol-1
Difusão e efusão
Difusão é o fenômeno em que um gás se espalha em outro meio gasoso. A efusão, por sua vez, é a passagem de um gás por um pequeno orifício do recipiente.
Thomas Graham estudou esses dois fenômenos e constatou que a velocidade de efusão ou de difusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
ATIVIDADES
4) Segundo o italiano Lorenzo Romano Amedeo Carlo Avogadro , “quando dois ou mais gases estão ocupando o mesmo volume, nas mesmas condições de temperatura e pressão, apresentam sempre o mesmo número de moléculas”. Baseado na afirmação proposta por ele, temos a seguir alguns recipientes fechados contendo gases, submetidos a uma mesma temperatura e pressão:

Em qual dos recipientes há um maior número de átomos de oxigênio e hidrogênio, respectivamente?
a) I e III b) I e IV c) II e III d) II e IV
5) O pneu de um automóvel foi regulado de forma a manter uma pressão interna de 21 libras-força por polegada quadrada, a uma temperatura de 14 ºC. Durante o movimento do automóvel, no entanto, a temperatura do pneu elevou-se a 55 ºC.
a) Mediante ao enunciado podemos concluir que a pressão interna no pneu irá aumentar, permanecer a mesma ou diminuirá?
b) A qual transformação gasosa este fato se refere?
6) (UFC) Acidentes com botijões de gás de cozinha são noticiados com bastante freqüência. Alguns deles ocorrem devido às más condições de industrialização (botijões defeituosos), e outros por uso inadequado. Dentre estes últimos, um dos mais conhecidos é o armazenamento dos botijões em locais muito quentes. Nestas condições, e assumindo a lei dos gases ideais, é correto afirmar que:
a) a pressão dos gases aumenta, e o seu número de mols diminui.
b) a pressão dos gases diminui, e o seu número de mols diminui.
c) o número de mols permanece constante, e a pressão aumenta.
d) a pressão e o número de mols dos gases aumentam.
e) a pressão e o número de mols dos gases não são afetados pelo aumento de temperatura.
7) (UNIRIO) Você brincou de encher, com ar, um balão de gás, na beira da praia, até um volume de 1 L e o fechou. Em seguida, subiu uma encosta próxima carregando o balão, até uma altitude de 900 m, onde a pressão atmosférica é 10 % menor do que a pressão ao nível do mar. Considerando que a temperatura na praia e na encosta seja a mesma, o volume de ar no balão, em L, após a subida, será de:
a) 0,8 b) 0,9 c) 1,0 d) 1,1 e) 1,2
8) Um certo gás, cuja massa vale 140g, ocupa um volume de 41 litros, sob pressão 2,9 atmosferas a temperatura de 17°C. O número de Avogadro vale 6,02. 1023 e a constante universal dos gases perfeitos R= 0,082 atm.L/mol.K.
Nessas condições, o número de moléculas continuadas no gás é aproximadamente de:
a) 3,00. 1024
b) 5,00. 1023
c) 6,02. 1023
d) 2,00. 1024
e) 3,00. 1029
Radioatividade
Habilidades Cognitivas:
|
(EM13CNT103X) Conhecer e analisar os tipos de radiação e suas origens, para avaliar as potencialidades e os riscos de sua aplicação em equipamentos de uso cotidiano, na saúde, no ambiente, na indústria, na agricultura e na geração de energia. |
Equipamento de detecção das radiações:
.jpg)
Alfa: é uma radiação corpuscular (partícula) constituida de dois prótons (próton: carga positiva e sendo uma unidade de massa) + dois nêutrons (nêutron: carga neutra e sendo uma unidade de massa); enfim alfa apresenta um número total de massa igual a 4 e número atômico igual a 2, onde a relação de carga positiva(prótons) e carga neutra (neutrôns) configura alfa como carga predominante positiva, assim será desviada por atração à placa negativa, porém com baixa intensidade de desvio por apresentar uma massa grande:

Gama: é uma onda eletromagnética, não possuindo carga e nem massa, ou seja, não é corpuscular,assim sendo não sofrerá desvio por não ser atraida nem pela placa positiva e nem pela placa negativa:

Beta: também se trata de uma radiação corpuscular, constiuida de um elétron (carga negativa e massa desprezível 1/1860 em comparação com um próton e/ou nêutron), porém este não pertence à eletrosfera, ele tem origem no núcleo com a quebra de um nêutron que se transforma num próton e num neutrino que ficam retidos no núcleo e libera uma radição beta; sendo assim beta é atraida pela placa positiva e apresenta um desvio maior do que alfa por apresentar uma massa menor:

Decaimento
Uma vez que se tem conhecimento estrutural e comportamenal de alfa, beta e gama podemos compreender o que acontece com um elemento radioativo que venha a emitir essas radiações (decaimento):
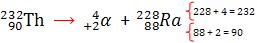
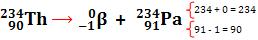
Obs: a emissão de gama não altera os números de massa e atômico, pois gama é uma onda eletromagnética isenta de massa.
*Poder de penetração das radiações:
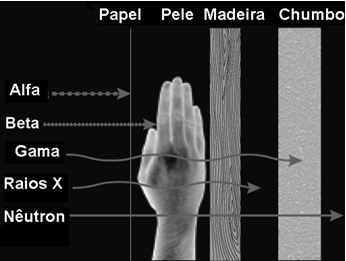
Como visto acima alfa apresenta um poder de penetração menor, isso por apresentar uma massa bem maior que gama (que diga de passagem não tem massa), e quanto maior a massa significa dificuldade de ultrapassar os espaços entre os átomos que constituem o material à sua frente. Nota-se no esquema também outras duas radiações (raios X e Nêutron), não vamos nos iludir com essa notícia "Reações Nucleares" e nos restringir apenas ao estudo de alfa, beta e gama, contudo o que geralmente a nível de ensino médio o que é cobrado recai sobre elas.
Meia-vida ou período de semidesintegração (t1/2): se trata do período que o material radioativo gasta (emitindo radiação) para se reduzir à metade de sua composição, seja em massa, em número de átomo etc...

Fissão Nuclear: se baseia na fragmetação de um material radioativo colidido por um nêutron transformando-se em elementos químicos mais simples além de liberação de mais nêutrons, o qual o número deste liberado depende da somatória do número de massa dos elementos mais simples formados, desde que haja a conservação da massa "lei de Lavoisier":

Observação: relação da massa envolvida no momento inicial e final da fissão acima: 1 + 235 = 139 + 94 + 3 x (1).
Fusão Nuclear: se baseia na formação de pelo menos um elemento químico mais complexo a partir de dois mais simples, que se chocam proporcionando essa transformação, não deixando de salientar a observação da conservação da massa "lei de Lavoisier":
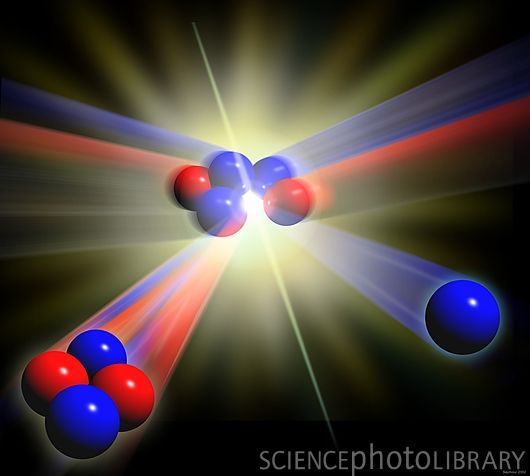
Observação: a relação que se faz energéticamente entre fissão e fusão nuclear é que a fusão apresenta em média uma quantidade energética 200 vezes maior em proporção à fissão nuclear.
ATIVIDADE
9) O elemento netúnio (93Np237), após a emissão de duas partículas alfa e três partículas beta, transforma-se num elemento químico com quais números de massa e atômico, respectivamente?
10) O xenônio-133 é usado em pesquisas sobre os pulmões, e sua meia-vida ou período de semidesintegração é de cinco dias. Se uma amostra contiver 200 mg de xenônio-133, qual era a sua massa a 10 dias?
11) A equação nuclear abaixo se refere:

a) decaimento b) fusão nuclear c) fissão nuclear d) combustão
12) Observe a equação nuclear abaixo:
94Pu242 --> 95Am242 + Z
Nessa equação, é correto afirmar que Z corresponde a qual radiação?
Observe a ilustração abaixo e responda as questões: 9 e 10:
.jpg)
13) Qual é a carga da radiação gama?
14) Qual o motivo da radiação alfa apresentar um desvio menos intenso na sua trajetória em relação à radiação beta?
Tópico: "2º ANO" 1º BIMESTRE-2024: Teoria Cinética Molecular, Estudo dos Gases e Radioatividade
Nenhum comentário encontrado.
