"1º ANO" 3º BIMESTRE-2024: Propriedades dos Materiais, Separação de Misturas e Substâncias Inorgânicas
Propriedades dos Materiais
Densidade
A densidade é uma propriedade da matéria que relaciona a massa e o volume de um corpo: d = m/V. O posicionamento dos fluidos em um sistema é consequência da densidade: mais denso mais baixo.

Atividades:
1) Um vidro contém 200 cm3 de mercúrio de densidade 13,6 g/cm3. A massa de mercúrio contido no vidro é:
a) 0,8 kg
b) 0,68 kg
c) 2,72 kg
d) 27,2 kg
e) 6,8 kg
2) Na tabela abaixo temos as densidades de alguns materiais sólidos. Se eles forem adicionados à água líquida e pura (densidade = 1 g/cm3), à temperatura ambiente, qual deles flutuará?
Pau-brasil .............................. 0,4 g/cm3
Alumínio ................................ 2,70 g/cm3
Diamante .................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Carvão ..................................... 0,5 g/cm3
Mercúrio .................................13,6 g/cm3
Solubilidade
As substâncias são miscíveis, ou seja, se misturam quando são semelhantes, polar mistura com polar e apolar mistura com apolar. Há substâncias que fogem a regra, pois apresentam em sua constituição características polar e apolar ao mesmo tempo, sendo assim capaz de se misturar com outras substâncias polares e/ou apolares.
Atividades:
3) Em qual das seguintes substâncias o benzeno (C6H6) que é apolar, é menos solúvel?
a) água (polar)
b) tetracloreto de carbono (apolar)
c) butanol (bipolar)
4) O detergente é considerado um material bipolar (hidrofílico e lipofílico), explique o motivo dessa característica fazer com que ele seja usado na limpeza de uma panela suja de óleo:
Estados Físicos da Matéria e suas Transformações
Os estados físicos são três com as suas respectivas características:
_ Sólido: as partículas estão bem: próximas umas das outras, organizadas, fortemente ligadas entre si e com pouca agitação.
_ Líquido: as partículas estão moderamente: próximas uma das outras, organizadas, ligadas entre si e agitadas.
_ Gasoso: as partículas estão totalmente: afastadas, desorganizadas, isoladas e muito agitadas.

As transformações físicas estão relacionadas ao resultado quantitativo entre a energia absorvida e a liberada por parte da matéria, sendo um sistema endotérmico (aquele onde a absorção de energia é maior do que a energia liberada) ou exotérmico (aquele onde a liberação de energia é maior do que a energia absorvida).

Observe que fusão e vaporização ocorre num sistema endotérmico e liquefação e solidificação ocorre num sistema exotérmico.
Observação: é muito importante associar a volatilidade da matéria com as ligações intermoleculares, sendo a mais volátil aquela que apresenta ligação entre moléculas apolares (dipolo instantâneo - dipolo induzido), e não deixando de notar que materiais apolares diferentes apresentam este tipo de ligação com intensidades diferentes.
Atividades:
5) Determine a qual estado de agregação a materia se apresenta mediante a cada característica abaixo:
a) apresenta partículas constituintes com alta agitação.
b) apresenta partículas bem organizadas.
c) apresenta partículas distânciadas de forma intermediária.
d) apresenta partículas que se deslocam isoladamente.
6) Observe:
I – O embaçamento do para-brisa de um automóvel.
II – Uma vasilha de água deixada no freezer;
III- Uma vasilha de água deixada no fogo;
IV – O derretimento de um pedaço de chumbo quando aquecido;
Nesses fatos estão relacionados corretamente os seguintes fenômenos:
a) I. Evaporação; II. Condensação; III. Fusão; IV. Solidificação.
b) I. Condensação; II. Condensação; III. Evaporação; IV. Solidificação.
c) I. Fusão; II. Condensação; III. Evaporação; IV. Solidificação.
d) I. Evaporação; II. Solidificação; III. Fusão; IV. Condensação.
e) I. Condensação; II. Solidificação; III. Ebulição; IV. Fusão.
Substância pura
É quando o sistema for formado por apenas um tipo de substância, ou seja, apresentando todas as partículas com as mesmas características. A substância pura apresenta as propriedades específicas da materia: temperatura de fusão, temperatura de ebulição, densidade e solubilidade entre outras, bem definidos.
O ouro 24 quilates, ou seja, 100 % ouro é um exemplo de substância pura.

Gráfico: temperatura X tempo, de uma substância pura, num sistema endotérmico, onde que ao passar do tempo a energia, calor, é absorvida:

Característiscas: apresenta dois patamares:
-
TF (temperatura de fusão, onde temos a passagem do estado físico sólido para o líquido numa temperatura constante, neste caso "t1 à t2" o calor absorvido tem como função proporcionar a transformação física).
-
TE (temperatura de ebulição, onde temos a passagem do estado físico líquido para o gasoso numa temperatura constante, neste caso "t3 à t4" o calor absorvido tem como função proporcionar a transformação física).
-
Nos intervalos de tempo: t0 à t1, t2 à t3 e t4 em diante o calor absorvido tem como função elevar as temperaturas da substância pura nos respectivos estados físicos: sólido, líquido e gasoso.
-
O gráfico do sistema exotérmico de uma substância pura é o oposto, ou seja, descendente, apresentando os dois patamares, sendo o primeiro de condensação e o segundo de solidificação:

Mistura:
É quando o sistema for formado por mais de um tipo de substância pura, podendo se apresentar homogêneo ou heterogêneo dependedo da solubilidade entre elas, ou seja, se são semelhantes (miscíveis) ou se não (imiscíves).
Gráfico: temperatura X tempo, de uma mistura comum, num sistema endotérmico:

Características: não há presença de nenhum patamar e sim de duas faixas (variáveis): a de fusão e de ebulição.
- No sistema exotérmico o gráfico é oposto descendente, apresentando as faixas de condensação e solidificação respectivamente:
Gráfico: temperatura X tempo, de uma mistura azeotrópica:

Características: há a presença de uma faixa (variável) de fusão e um patamar temperatura de ebulição (constante).
Gráfico: temperatura X tempo, de uma mistura eutética:

Características: há a presença de um patamar (constante) temperatura de fusão e uma faixa (variável) de ebulição.
Atividades:
7) O gráfico abaixo representa a variação de temperatura observada no aquecimento de uma determinada substância:

Relacione as colunas com informações a respeito do gráfico em questão:
Coluna 1:
1. Faixa de temperatura em que a substância permanece sólida;
2. Faixa de temperatura em que a substância permanece totalmente líquida;
3. Temperatura de ebulição;
4. Temperatura de fusão;
5. Tempo que a fusão demora;
6. Tempo em que a substância permanece líquida.
Coluna 2:
( ) 10 minutos.
( ) 20 ºC.
( ) Entre 10 a 20 ºC.
( ) 20 minutos.
( ) Entre 20 a 40 ºC.
( ) 40ºC.
8) (UFPA) Dado o diagrama de aquecimento de um material:

A alternativa correta é:
a) o diagrama representa o resfriamento de uma substância pura.
b) a temperatura no tempo zero representa o aquecimento de um líquido.
c) 210°C é a temperatura de fusão do material.
d) a transformação de X para Y é um fenômeno químico.
e) 80°C é a temperatura de fusão do material.
Processos de Separação de Misturas
São procedimentos usados com o objetivo de separar os componentes das misturas até que cada substância pura fique totalmentente isolada das demais. Essa separação chama-se desdobramento (ou fracionamento, ou resolução, ou, ainda análise imediata da mistura). Abaixo estão alguns exemplos importantes a serem entendidos:
Extração: o solvente em temperatura elevada retira substância de uma mistura:
Quando preparamos café (ou chá), a água quente faz a extração de componentes do pó de café (ou das folhas do chá), dando a origem à bebida.

Ventilação: a leveza de uma substância faz com que seja deslocada da mistura a que pertence:
Quando lança para cima a mistura de arroz e palha de arroz, a lavradora deixa que a corrente de ar arraste a palha.

Peneiração ou Tamisação: a diferença no tamanho das substâncias permite a retenção das maiores por uma peneira:
Ao passar a areia pela peneira, separando-a de pedregulhos e outros materiais grosseiros.

Filtração: um sistema heterogêneo seja ele formado por sólido-gás ou sólido-líquido, as partículas sólidas de tamanho imcompatível com os poros são retidas pelo filtro:
O coador retém as partículas sólidas do café.
Sedimentação: um sistema heterogêneo seja ele sólido-liquido ou líquidos imiscíveis, onde a substância mais densa se precipita, ou seja, afunda após um determinado tempo de repouso:
A areia que está em suspensão na água vai, lentamente, se depositando no fundo do recipiente.

Decantação: um sistema heterogêneo seja ele formado por sólido-líquido ou dois líquídos imiscíveis entre si:
A água mais densa pode ser separada do óleo, pela gravidade, abrindo lentamente uma vazão inferior.

Sifonação: um sistema heterogêneo seja ele formado por sólido-líquido ou líquidos com diferentes densidades, onde usa-se a sucção através de uma mangueira considerando altitudes diferentes entre os recipientes (o que contém a mistura e o que receberá a substância sugada):
Em cozinhas e banheiros também é comum o uso de sifonação para vazão contínua da água e retenção de algum sólido.

Centrifugação: associa a velocidade de rotação com a diferença de densidade das substâncias da mistura onde a mais densa vai para o fundo do tubo de ensaio:
O processo de separação de alguns componentes do sangue:

Em hospitais e hoteis é muito comum o uso de centrífugas para secar a roupa, devido à necessidade de precisar de roupas limpas constantemente.
Destilação Simples: usado para separar uma mistura de líquido e sólido dissolvido não facilmente volátil (que não passa do estado físico líquido para gasoso com baixas temperaturas de ebulição):
Quando a cozinheira da um ponto no doce em calda:
Destilação Fracionada: usado na separação de dois ou mais líquidos miscíveis que apresentam temperaturas de ebulição diferentes, onde por ordem crescente de temperatura de ebulição vai separando a substância mais volátil (aquela que apresenta menor temperatura de ebulição):
A separação dos derivados do petróleo:

Separação Magnética: aplicada em misturas onde um dos componentes apresenta propriedades magnéticas:

Atividades:
9) Para a separação das misturas: gasolina-água e álcool-água-acetona, os processos mais adequados são respectivamente:
a) decantação e destilação fracionada.
b) sedimentação e destilação simples.
c) filtração e separação magnética.
d) destilação e extração.
Substâncias Inorgânicas
Habilidades Cognitivas:
|
20.1.1. Propor e/ou executar procedimentos simples para a identificação do caráter ácido, básico ou neutro de soluções por meio de indicadores. 20.1.2. Representar ou identificar, por meio de equações ou fórmulas químicas, sistemas que apresentem caráter ácido, básico ou neutro. 21.1.1. Representar, por meio de equações químicas, as reações de neutralização ácido-base. |
Ácidos: definição de Arrhenius:
_ são compostos moleculares, constituídos por átomos ametálicos: HCl, H2SO4;
_ condutores de eletricidade quando em solução aquosa ( pois se ionizam, ou seja, formam íons livres) sendo produzido como único cátion hidrogênio H+:
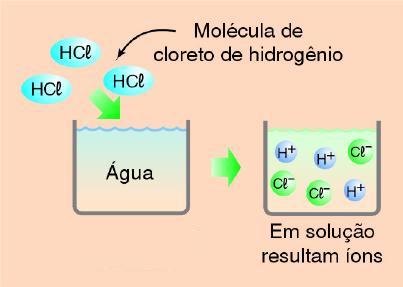
Obs: pela diferença de eletronegatividade (H=2,1 e Cl=3,0) na ionização o Cl se transforma em ânion "íon de carga negativa" (ficando com o par de elétrons, que antes era compartilhado com o hidrogênio) e o hidrogênio se transforma no cátion "íon de carga positiva";
_ mudando a cor de certas substâncias, sendo por isto, chamados de indicadores de ácidos:

Obs: A hortência, produz flores azuis em solos ácidos;
_ apresentam pH abaixo de 7, pH (potencial de hidrogênio é uma faixa numérica de 0 à 14 usada para indicar o carater ácido, neutro ou básico de um material:
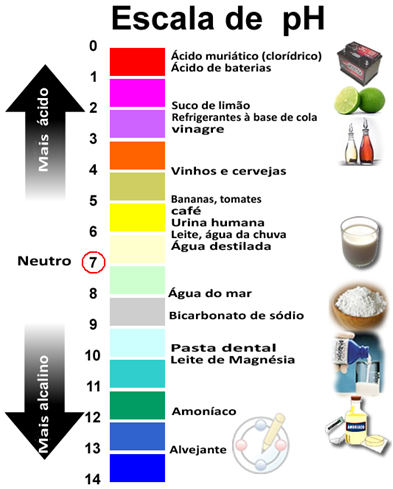
_ os comestíveis apresentam sabor azedo:

Obs: entre outras as frutas cítricas;
_ são corrosivos: classificados em fracos (grau percentual de ionização menor que 5%), moderados (grau percentual de ionização maior que 5% e menor que 50%) e fortes (grau percentual de ionização maior que 50%)
Obs: O fato do ácido ser fraco, moderado ou forte esta na sua capacidade de sofrer ionização, ou seja, a molécula ser quebrada, rompendo as ligações covalentes e formando assim os íons.
_ Classificados em oxiácido (H2SO4) e hidrácidos (HBr), quando o oxigênio está presente e quando o oxigênio está ausente, respectivamente;
_ Classificados em mono, di, triácidos de acordo com o número de átomos de hidrogênio na molécula;
Bases ou Hidróxidos: definição de Arrhenius
_ são compostos iônicos, constituidos por átomos: metálicos e ametálicos:
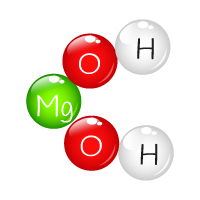
_ condutores de eletricidade quando em solução aquosa ( pois sofrem dissociação iônica, separação de íons, sendo como único ânion formado do tipo OH- "hidroxila ou oxidrila"):

_ fazem voltar a cor primitiva dos indicadores, caso essa cor tenha sido alterada por um ácido (essa característica das bases dá sentido ao nome indicadores ácido-base), apresentam pH acima de 7 até 14,
_ os comestíveis apresentam sabor adstringente:

_ são fracos quando apresentam grau de dissociação em porcentagem menor do que 5% e fortes quando o grau é praticamente 100%.
Dica:
Quando você passar por um jardim, que nele tenha plantado Hortência, observe as cores das flores se for rosa o solo é básico:

Relação ácido e base (Reação de Neutralização Ácido-Base)
As substâncias ácidas apresentam características opostas às substâncias básicas, assim é comum dizer que o ácido neutraliza a base e vice-versa, a partir dai podemos entender a reação de neutralização ácido-básico:

observe que nessa reação deixamos de ter o ácido (HNO3) e a base (KOH) devido a transformação desses em água (H2O) "óxido" e sal (KNO3); podendo concluir que o meio passa a apresentar geralmente um pH neutro igual a 7, mas há sais e óxidos ácidos, sais e óxidos básicos, que nesses casos apresentam pH nas respectivas faixas para ácido e base quando em solução.
Sais: definição de Arrhenius
_ são compostos formados juntamente com a água na reação de um ácido com uma base:
_ sendo iônicos (formados por metais e ametais), que possuem, pelo menos, um cátion diferente do H+ e um ânion diferente do OH-:
NaCl (dissociação iônica) = Na+ Cl-
_ a maioria condutores de eletricidade, quando em solução aquosa ou quando fundidos devido a dissociação iônica (separação de íons e esses ficando livres):
_ geralmente na medida de pH apresentam valor 7 (neutro), mas há exceções: sais ácidos e sais básicos, que nesses casos apresentam pH nas respectivas faixas para ácido e base quando em solução.
Óxidos:
_ são compostos binários (constituidos por apenas dois tipos de elementos químicos), sendo obrigatoriamante um deles o oxigênio juntamente com qualquer outro elemento químico, exceto o flúor, pois o oxigênio tem que ser o mais eletronegativo.
Atividades:
10) Faça a associação correta entre as colunas abaixo:
a) NaOH, Ca(OH)2, NH4OH ( ) ácidos
b) NaCℓ, KNO3, Na2S ( ) bases
c) HCℓ, H2SO4, HNO3 ( ) sais
d) CO, Al2O3, Pb3O4 ( ) óxidos
11) Um solo que apresenta pH igual a 8,2 apresenta caráter:
a) ácido
b) básico
c) salino
d) neutro
12) A seguir, temos várias reações não balanceadas. Qual delas não corresponde a uma reação de neutralização?
a) KOH(aq) + H2CO3(aq) → K2CO3(aq) + H2O(ℓ)
b) Ca(OH)2(aq) + 2 HF(aq) → CaF2(aq) + 2 H2O(ℓ)
c) CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(ℓ)
d) 2 HCl(aq) + Mg(OH)2(aq) → MgCl2(aq) + 2 H2O(ℓ)
Tópico: "1º ANO" 3º BIMESTRE-2024: Propriedades dos Materiais, Separação de Misturas e Substâncias Inorgânicas
Nenhum comentário encontrado.
